আগুনের মধ্যে একটি লোহার দণ্ড ধরলে লোহার দণ্ডটি গরম হয়ে যায়। আবার গরম লোহার দণ্ডটিকে বরফের সংস্পর্শে আনলে দণ্ডটি ঠান্ডা হয়ে যায়। এ থেকে বোঝা যায় যে ঠান্ডা বস্তু একটি বিশেষ ধরনের শক্তি গ্রহণ করে গরম হয় এবং গরম বস্তু ওই শক্তি বর্জন করে ঠান্ডা হয়। এই শক্তি যা গরম বস্তু থেকে ঠান্ডা বস্তুতে সঞ্চালিত হয় তা কোনো যান্ত্রিক পদ্ধতিতে হয় না। এর অস্তিত্ব আমরা কেবল অনুভব করতে পারি। এই বিশেষ শক্তিকে তাপ বলে ৷
তাপ হল এক প্রকার শক্তি যা কোনো যান্ত্রিক পদ্ধতি ছাড়াই এক বস্তু থেকে অপর বস্তুতে সঞ্চালিত হয় এবং যা গ্রহণ করলে বস্তু গরম হয় ও বর্জন করলে বস্তু ঠান্ডা হয় ৷
তাপ তিন প্রকারের হয়, যেমন— বোধগম্য তাপ, লীনতাপ ও বিকীর্ণ তাপ ।
তাপের বহিঃপ্রকাশগুলি হল –
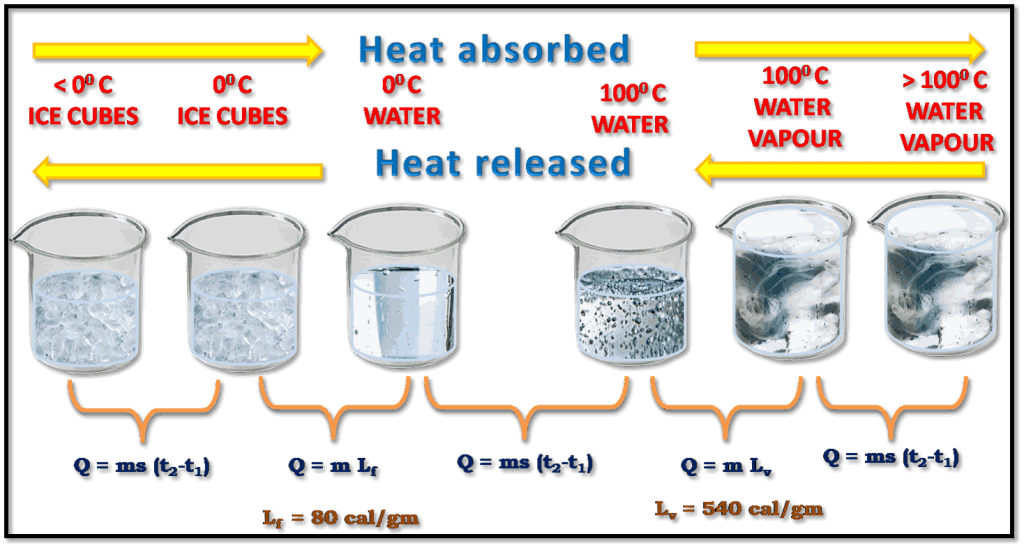
অবস্থার পরিবর্তন: সাধারণত কোনো কঠিন পদার্থের উপর তাপ প্রয়োগ করলে সেটি তরলে পরিণত হয় এবং তরল পদার্থের উপর তাপ প্রয়োগ করলে সেটি বাষ্পে পরিণত হয়।
তাপমাত্রার পরিবর্তন: বস্তুর উপর তাপ প্রয়োগ করলে সেটির তাপমাত্রা বৃদ্ধি পায় (যতক্ষণ না সেটির অবস্থার পরিবর্তন হয়)
আয়তনের পরিবর্তন: সাধারণত তাপ প্রয়োগে বস্তুর আয়তন বৃদ্ধি পায় এবং তাপ হ্রাসে আয়তন হ্রাস পায়।
রাসায়নিক পরিবর্তন: তাপ প্রয়োগে অনেক রাসায়নিক পরিবর্তন ঘটানো যায়। যেমন –
CaCO3 + Heat > CaO + CO2
6.1 ক্যালোরিমিতি (Calorimetry)
তাপ একটি প্রাকৃতিক রাশি। সুতরাং, তাপের পরিমাপ করা সম্ভব। যখন কোনো বস্তু তাপ গ্রহণ বা বর্জন করে তখন বস্তুর উষ্ণতা বৃদ্ধি বা হ্রাস পায়।
যে পদ্ধতিতে বস্তুর গৃহীত বা বর্জিত তাপ পরিমাপ করা হয় তাকে ক্যালোরিমিতি বলে।
তোমরা সপ্তম শ্রেণিতে জেনেছ, বস্তুর উয়তা বাড়াতে প্রয়োজনীয় তাপ নির্ভর করে বস্তুর উষ্ণতা বৃদ্ধির পরিমাণের ওপর, বস্তুর ভরের ওপর ও বস্তু কোন্ উপাদানে তৈরি তার ওপর।
তোমরা অষ্টম শ্রেণিতে জেনেছ, বস্তুর উয়তা বৃদ্ধি বা হ্রাসের জন্য গৃহীত বা বর্জিত তাপের পরিমাপের রাশিমালা ।
গৃহীত তাপ বা বর্জিত তাপ = বস্তুর ভর x আপেক্ষিক তাপ × উষ্ণতা বৃদ্ধি বা হ্রাস
অর্থাৎ, Q = mst,
যেখানে m = বস্তুর ভর, s = বস্তুর আপেক্ষিক তাপ, t= উয়তার পরিবর্তন।
কোনো বস্তুর একক ভরের তাপমাত্রা 1° বৃদ্ধি করতে যে পরিমাণ তাপ লাগে তাকে ওই বস্তুর আপেক্ষিক তাপ বলে। সিজিএস পদ্ধতিতে আপেক্ষিক তাপের একক ক্যালোরি/গ্রাম-°C। এসআই পদ্ধতিতে এর একক জুল/কেজি-কেলভিন। আপেক্ষিক তাপ ‘s’ অক্ষর দ্বারা প্রকাশ করা হয়। আপেক্ষিক তাপের মাত্রা হল [L2T-2K-4]
জেনে রেখো: CGS পদ্ধতিতে তাপের একক ক্যালোরি (cal)। SI পদ্ধতিতে তাপের একক জুল (J)। 1 cal = 4.2 J
6.1.1 ক্যালোরিমিতির মূলনীতি (Principle of calorimetry)
ধরা যাক, A এবং B দুটি বস্তু। A বস্তুর তাপমাত্রা B বস্তুর তাপমাত্রার চেয়ে বেশি। এখন বস্তু দুটিকে পরস্পরের সংস্পর্শে আনা হল। এখন A বস্তু তাপ বর্জন করবে এবং B বস্তু সেই তাপ গ্রহণ করবে। ফলে A বস্তুর তাপমাত্রা কমবে এবং B বস্তুর তাপমাত্রা বাড়বে। এইভাবে তাপ গ্রহণ ও বর্জন চলবে যতক্ষণ না উভয়ের তাপমাত্রা সমান হয়। যদি তাপ গ্রহণ ও বর্জনের সময় কোনো তাপ নষ্ট না হয়, তবে A বস্তু যে পরিমাণ তাপ বর্জন করবে, B বস্তু ঠিক সেই পরিমাণ তাপ গ্রহণ করবে।
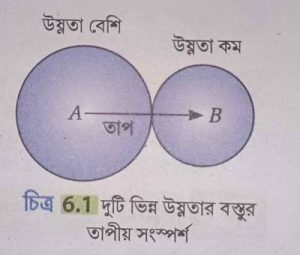
অর্থাৎ, উষ্ণতর বস্তু দ্বারা বর্জিত মোট তাপ = শীতলতর বস্তু দ্বারা গৃহীত মোট তাপ। এটিই ক্যালোরিমিতির মূলনীতি।
উদাহরণ : ধরা যাক, A বস্তুর ভর M গ্রাম, আপেক্ষিক তাপ s1 ক্যালোরি/গ্রাম-°C এবং উয়তা t1°C। B বস্তুর ভর m গ্রাম, আপেক্ষিক তাপ s2 ক্যালোরি/গ্রাম-°C এবং উয়তা t2°C, t1 >t2। তাপ গ্রহণ ও বর্জনের পর উভয় বস্তুর উন্নতা হয় t0C
A বস্তু দ্বারা বর্জিত তাপ (Q1) = M x s1 × (t1 – t) ক্যালোরি = Ms1 (t1 – t) ক্যালোরি
B বস্তু দ্বারা গৃহীত তাপ (Q2) = m x s2 x (t – t2) ক্যালোরি = ms2 (t-t2) ক্যালোরি।
সুতরাং, ক্যালোরিমিতির মূলনীতি অনুযায়ী, Q1 = Q2 বা, Ms1 (t1 – t) = ms2 (t – t2)
[ধরে নেওয়া হয়েছে তাপ গ্রহণ বা বর্জনের সময় কোনো তাপ নষ্ট হয়নি।