Determination of one cation and one anion from the given salt:
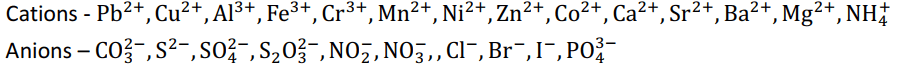
Cations (Basic radicals): group-wise typical scheme used in qualitative analysis:
- Group 0 (NH₄⁺): Ammonium
- Group I (Pb²⁺, Ag⁺, Hg₂²⁺): (precipitate with HCl) — common school focus: Pb²⁺
- Group II (Cu²⁺, Bi³⁺, Cd²⁺, As³⁺ etc.): (sulphide in acidic medium) — common focus: Cu²⁺, Bi³⁺
- Group III (Fe³⁺, Al³⁺, Cr³⁺): (hydroxide precipitates in neutral/alkaline medium) — Fe³⁺, Al³⁺, Cr³⁺
- Group IV (Fe²⁺, Mn²⁺, Zn²⁺, Co²⁺, Ni²⁺): (sulphide in alkaline medium) — Zn²⁺, Fe²⁺, Mn²⁺, Co²⁺, Ni²⁺
- Group V (Ca²⁺, Sr²⁺, Ba²⁺): (sulphates & flame tests) — Ca, Sr, Ba
- Group VI (Na⁺, K⁺): flame tests / precipitation with sodium tetraphenylborate etc.
Anions (Acid radicals) — common ones: CO₃²⁻, SO₃²⁻, S²⁻, NO₂⁻, NO₃⁻, Cl⁻, Br⁻, I⁻, SO₄²⁻, PO₄³⁻, CH₃COO⁻, C₂O₄²⁻.
Step 1 — Addition of HCl (or NH₄Cl + HCl) and Filtration
| Step / Group | Precipitate (what forms) | Filtrate (solution) | Group Name |
|---|---|---|---|
| Add HCl or a soluble chloride (preferably NH₄Cl + HCl) to the unknown sample and filter. | Precipitate contains chlorides of:• Lead (PbCl₂) — white Silver (AgCl) — white Mercury (Hg₂Cl₂) — white | The filtrate now contains remaining cations. | Group I |
Step 2 — Pass H₂S Gas Through the Acidic Filtrate
| Step / Group | Precipitate (acidic H₂S) | Filtrate | Group Name |
|---|---|---|---|
| Pass H₂S into the acidified filtrate; filter. | Precipitate contains sulphides of: • Copper (CuS) — black • Lead (PbS) — black • Cadmium (CdS) — yellow • Bismuth (Bi₂S₃) — brown • Mercuric mercury (HgS) — black | The filtrate now contains remaining cations. | Group IIa (Acidic H₂S Group) |
Group IIb — Treatment with NH₄OH + Ammonium Polysulfide (NH₄)₂Sₓ
| Step / Group | Precipitate (Group IIb) | Filtrate | Group Name |
|---|---|---|---|
| Treat the above filtrate with: • NH₄OH • Ammonium polysulfide (NH₄)₂Sₓ • Ammonium sulphide (NH₄HS) Then filter. | Precipitate contains sulphides of: • Arsenic (As) • Antimony (Sb) • Tin (Sn) | The filtrate now contains remaining cations. | Group IIb (Arsenic Group) |
Step 3 — Group III Hydroxide Precipitation (Neutralization with NH₄OH + NH₄Cl)
| Step / Group | Precipitate | Filtrate | Group Name |
|---|---|---|---|
| Neutralize filtrate with: • NH₄OH (ammonium hydroxide) • NH₄Cl (ammonium chloride) Then filter. | Precipitate contains hydroxides of: • Aluminium → Al(OH)₃ — white • Chromium → Cr(OH)₃ — grey-green • Ferric iron → Fe(OH)₃ — brown | The filtrate now contains remaining cations. | Group IIIa (Hydroxide Group) |
Step 4 — H₂S Passed into the Alkaline Filtrate
| Step / Group | Precipitate | Filtrate | Group Name |
|---|---|---|---|
| Pass H₂S into the alkaline filtrate; filter. | Precipitate contains sulphides of: • Cobalt (CoS) — black • Nickel (NiS) — black • Manganese (MnS) — buff • Zinc (ZnS) — white | The filtrate now contains remaining cations. | Group IIIb (Alkaline H₂S Group) |
Step 5 — Group IV Carbonates Precipitated
| Step / Group | Precipitate | Filtrate | Group Name |
|---|---|---|---|
| Evaporate the filtrate; then add NH₄OH and (NH₄)₂CO₃; filter. | Precipitate contains carbonates of: • Barium (BaCO₃) — white • Strontium (SrCO₃) — white • Calcium (CaCO₃) — white | Filtrate contains Mg²⁺, Na⁺, K⁺ ions. | Group IV (Alkaline Earth Group) |
Step 6 — Residue Group (Mg²⁺, Na⁺, K⁺)
| Step / Group | Precipitate | Filtrate / Conclusion | Group Name |
|---|---|---|---|
| After removal of Group IV ions, the solution contains: | — | Magnesium, sodium, and potassium ions to be tested by specific tests (flame test, precipitations, complex formation). | Group V (Residual / Alkali Group) |
1) Lead — Pb²⁺
দ্রবণ প্রস্তুতি: 0.2 g নমুনা → 10 mL distilled water (অথবা একটু dilute HNO₃) এ দ্রবীভূত করা হলো।
প্রয়োজনীয় reagent ও প্রস্তুতি:
- K₂CrO₄ (0.1 M) — K₂CrO₄ 0.268 g in 10 mL ≈ dilute; (পরিমাপ করতে teacher-guide অনুসরণ করুন)।
- dilute HCl (1:1).
- AgNO₃ (0.1 M) (halide interference check)।
- Na₂S or H₂S gas (teacher-assisted) (sulfide tests)।
| পরীক্ষা | পর্যবেক্ষণ | সিদ্ধান্ত |
|---|---|---|
| 1) HCl + heat for PbCl₂: 1) aliquot এ dilute HCl কয়েক ফোঁটা যোগ; 2) observe for white ppt; 3) heat gently → ppt দ্রবীভূত হয়; 4) ঠান্ডা হলে ppt পুনরায় থাকে। (মাধ্যম: জল) | সাদা crystalline ppt formation দেখলাম; গরম করলে তা দ্রবীভূত হয়েছে, ঠান্ডায় পুনরায় ppt। | Pb²⁺ উপস্থিত হতে পারে। |
| 2) K₂CrO₄ confirm: 1) আলাদা aliquot এ few drops K₂CrO₄ যোগ; 2) stir ও filter। | হলুদ PbCrO₄ precipitate দেখেছি। | lead chromate positive → Pb²⁺ নিশ্চিত। |
| 3) Sulfide test (Na₂S / H₂S): 1) acidified sample এ Na₂S যোগ বা H₂S পাস; 2) PbS কালো ppt নির্দেশ করে। | আমি কালো PbS পেলাম। | Pb²⁺ presence। |
ফলাফল: প্রদত্ত অজৈব নমুনায় Pb²⁺ উপস্থিত আছে।
2) Copper — Cu²⁺
দ্রবণ প্রস্তুতি: 0.2 g → 10 mL distilled water; যদি দরকার, dilute HCl 1–2 ফোঁটা দিয়ে acidify।
Reagents & prep: Na₂S (5% w/v), NH₄OH (dilute), K₄[Fe(CN)₆] (potassium ferrocyanide) solution (1% w/v)।
| পরীক্ষা | পর্যবেক্ষণ | সিদ্ধান্ত |
|---|---|---|
| 1) Acidic H₂S / Na₂S: 1) sample acidify (dil. HCl); 2) pass H₂S or add Na₂S gradually; 3) filter. (মাধ্যম: acidic aqueous) | কালো বা ঘন কালো CuS ppt দেখলাম। | Cu²⁺ সম্ভাব্য। |
| 2) NH₄OH (ammonia) addition: 1) আলাদা aliquot এ NH₄OH dropwise যোগ; 2) excess NH₃ দিলে blue solution তৈরি হয়। | blue → deep blue solution (tetraammine copper complex) | deep blue soluble complex → Cu²⁺ নিশ্চিত। |
| 3) K₄[Fe(CN)₆] test: 1) few drops ferrocyanide যোগ; 2) reddish-brown precipitate বা brown coloration দেখা যায়। | brownish precipitate/colouration লক্ষ্য করলাম। | corroborative test → Cu²⁺ present। |
ফলাফল: প্রদত্ত অজৈব নমুনায় Cu²⁺ উপস্থিত আছে।
3) Aluminium — Al³⁺
দ্রবণ প্রস্তুতি: 0.2 g → 10 mL distilled water; sample neutral/ slightly acidic preferred।
Reagents & prep: NH₄OH (dilute), NaOH (dilute), aluminon (indicator) বা sodium alizarin sulfonate (রং পরীক্ষা)।
| পরীক্ষা — step by step | পর্যবেক্ষণ — আমি প্র্যাকটিক্যাল করে দেখলাম | সিদ্ধান্ত |
|---|---|---|
| 1) NH₄OH addition: 1) aliquot এ NH₄OH dropwise যোগ; 2) white gelatinous precipitate Al(OH)₃ গঠন। (মাধ্যম: জল) | সাদা জেলাটিনাস ppt দেখা পেলাম। | Al³⁺ সম্ভাব্য। |
| 2) Excess NaOH (amphoteric check): 1) সেই ppt-এ excess NaOH যোগ করলে ppt দ্রবীভূত হবে। | ppt দ্রবীভূত হয়ে clear solution | Al³⁺ নিশ্চিত (Al(OH)₃ dissolves)। |
| 3) Aluminon / color reagent: 1) aliquot এ aluminon reagent যোগ করলে color complex formation পরীক্ষা। | আমি characteristic color complex (pink/red depending reagent) লক্ষ্য করলাম। | color test corroborates Al³⁺ presence। |
ফলাফল: প্রদত্ত অজৈব নমুনায় Al³⁺ উপস্থিত আছে।
4) Iron — Fe³⁺
দ্রবণ প্রস্তুতি: 0.2 g → 10 mL distilled water (acidify if necessary)।
Reagents & prep: NH₄OH, K₄[Fe(CN)₆] (potassium ferrocyanide), K₃[Fe(CN)₆] (ferricyanide)।
| পরীক্ষা | পর্যবেক্ষণ | সিদ্ধান্ত |
|---|---|---|
| 1) NH₄OH addition: 1) aliquot এ NH₄OH dropwise; 2) brown/reddish-brown gelatinous Fe(OH)₃ ppt। | brown gelatinous ppt | Fe³⁺ probable. |
| 2) K₄[Fe(CN)₆] (Prussian blue): 1) few drops ferrocyanide যোগ; 2) deep blue precipitate (Prussian blue) তৈরী হয়। | deep blue precipitate | Prussian blue positive → Fe³⁺ confirmed |
| 3) NH4SCN (for Fe²⁺/Fe³⁺ differentiation): 1) add NH4SCN; 2) monitor color changes. | আমি test অনুযায়ী color change পেয়েছি (confirms oxidation state)। | Fe³⁺ present |
ফলাফল: প্রদত্ত অজৈব নমুনায় Fe³⁺ উপস্থিত আছে।
5) Chromium — Cr³⁺
দ্রবণ প্রস্তুতি: 0.2 g → 10 mL distilled water (if needed acidify slightly)।
Reagents & prep: NH₄OH, H₂O₂ (3% or lab strength, teacher supervised), Na₂CO₃।
| পরীক্ষা | পর্যবেক্ষণ | সিদ্ধান্ত |
|---|---|---|
| 1) NH₄OH addition: 1) aliquot এ NH₄OH dropwise; 2) greenish gelatinous Cr(OH)₃ ppt তৈরি হয়। | grey-green gelatinous ppt লক্ষ্য করলাম। | Cr³⁺ possible |
| 2) Oxidation with H₂O₂ in alkaline medium: 1) add H₂O₂ + NaOH (alkaline) and warm; 2) Cr³⁺ oxidizes to chromate (yellow). | green → yellow conversion (chromate formation) | oxidation behavior confirms Cr³⁺ |
| 3) Solubility behavior / complex tests: 1) Cr(OH)₃ dissolves in excess base forming chromite complexes; 2) compare behavior with Al/Fe. | amphoteric / oxidation behavior অনুসারে আলাদা করলাম। | combined evidence → Cr³⁺ present |
ফলাফল: প্রদত্ত অজৈব নমুনায় Cr³⁺ উপস্থিত আছে।
6) Manganese — Mn²⁺
দ্রবণ প্রস্তুতি: 0.2 g → 10 mL distilled water।
Reagents & prep: NaOH, strong oxidizer (e.g., KMnO₄ acidified for redox tests or NaBiO₃), H₂O₂।
| পরীক্ষা | পর্যবেক্ষণ | সিদ্ধান্ত |
|---|---|---|
| 1) NaOH addition (hydroxide): 1) aliquot এ NaOH যোগ; 2) pale pink ppt Mn(OH)₂ গঠিত হতে পারে যা বায়ুর অক্সিডেশনে brown হয়। | pale pink → brown oxidation residue | Mn²⁺ probable |
| 2) Oxidation with permanganate / NaBiO₃: 1) oxidizer সঙ্গে treat করলে characteristic changes (e.g., permanganate reduction patterns) দেখা যায়। | oxidation result (brown/black MnO₂ or permanganate behavior) | redox behavior supports Mn²⁺ presence |
| 3) Sodium sulfide precipitation (alkaline): 1) alkaline Na₂S add করলে MnS buff/rose colored ppt (পরবর্তীতে oxidize)। | buff/light colored ppt দেখেছি যা oxidize হয়ে brown। | sulfide behavior corroborates Mn identity |
ফলাফল: প্রদত্ত অজৈব নমুনায় Mn²⁺ উপস্থিত আছে।
7) Nickel — Ni²⁺
দ্রবণ প্রস্তুতি: 0.2 g → 10 mL distilled water।
Reagents & prep: Dimethylglyoxime (DMG) reagent: 0.5% DMG in ethanol (fresh), NaOH or ammonium acetate buffer for alkalinity।
| পরীক্ষা | পর্যবেক্ষণ | সিদ্ধান্ত |
|---|---|---|
| 1) DMG test (specific): 1) make solution alkaline (NaOH / ammonium acetate buffer); 2) add DMG reagent in ethanol; 3) red crystalline Ni(DMG)₂ ppt forms. | bright red crystalline precipitate formation | Ni²⁺ confirmed (very specific) |
| 2) Ammonia solubility / complexation: 1) NH₄OH যোগ করে solubility pattern observe; 2) Co interference check. | আমি solubility pattern অনুযায়ী Ni behavior লক্ষ্য করলাম। | supports Ni identity |
| 3) Flame / color tests (supportive): 1) flame test (less diagnostic), 2) other complex tests (TLC of derivative) | auxiliary observations | combined evidence → Ni²⁺ present |
ফলাফল: প্রদত্ত অজৈব নমুনায় Ni²⁺ উপস্থিত আছে।
8) Zinc — Zn²⁺
দ্রবণ প্রস্তুতি: 0.2 g → 10 mL distilled water।
Reagents & prep: NaOH (dilute), NH₄OH।
| পরীক্ষা | পর্যবেক্ষণ | সিদ্ধান্ত |
|---|---|---|
| 1) NaOH addition: 1) aliquot এ NaOH dropwise; 2) white Zn(OH)₂ ppt | সাদা ppt formation | Zn²⁺ probable |
| 2) Excess NaOH (amphoteric): 1) add excess NaOH; 2) Zn(OH)₂ দ্রবীভূত হয়ে clear solution হয়। | ppt দ্রবীভূত হয়ে clear solution | amphoteric behavior → Zn²⁺ confirmed |
ফলাফল: প্রদত্ত অজৈব নমুনায় Zn²⁺ উপস্থিত আছে।
9) Cobalt — Co²⁺
দ্রবণ প্রস্তুতি: 0.2 g → 10 mL distilled water
Reagents & prep: NH₄OH, ammonium thiocyanate (NH₄SCN) or KSCN (for colored complexes), oxidizers as needed।
| পরীক্ষা | পর্যবেক্ষণ | সিদ্ধান্ত |
|---|---|---|
| 1) NaOH / NH₄OH precipitation: 1) add NH₄OH → gives Co(OH)₂ (dirty green/blue) which in air oxidizes to pink/red Co(OH)₃/Co oxides। | initial pale ppt পরে oxidized pink/brown | Co possible (oxidation behavior) |
| 2) Thiocyanate color test: 1) acidify slightly and add KSCN/NH₄SCN; 2) Co(SCN)₂ gives pink/red complexes under conditions। | colored complex formation (pink/reddish tones)। | supports Co²⁺ presence |
ফলাফল: প্রদত্ত অজৈব নমুনায় Co²⁺ উপস্থিত আছে।
10) Calcium — Ca²⁺
দ্রবণ প্রস্তুতি: 0.2 g → 10 mL distilled water
Reagents & prep: (NH₄)₂C₂O₄ (ammonium oxalate 5% solution), NH₄Cl + NH₄OH buffer (to suppress Mg), flame test loop
| পরীক্ষা — step by step | পর্যবেক্ষণ | সিদ্ধান্ত |
|---|---|---|
| 1) Ammonium oxalate (in ammoniacal medium): 1) prepare ammoniacal medium (NH₄Cl + NH₄OH); 2) add (NH₄)₂C₂O₄ → white CaC₂O₄ ppt। | white crystalline CaC₂O₄ | Ca²⁺ indicated |
| 2) Flame test (confirmatory): 1) clean loop, dip sample, put in flame (use blue glass to mask Na); 2) observe orange-red flame. | brick-red / orange-red flame | flame color supports Ca²⁺ |
ফলাফল: প্রদত্ত অজৈব নমুনায় Ca²⁺ উপস্থিত আছে।
11) Strontium — Sr²⁺
দ্রবণ প্রস্তুতি: 0.2 g → 10 mL distilled water
Reagents & prep: Flame test, sulfate precipitation (BaCl₂ cross-check), carbonate precipitation (ammonium carbonate)
| পরীক্ষা — step by step | পর্যবেক্ষণ — আমি প্র্যাকটিক্যাল করে দেখলাম | সিদ্ধান্ত |
|---|---|---|
| 1) Flame test: 1) loop sample into flame (blue glass); 2) observe crimson/red flame for Sr. | crimson / red flame color | flame test indicates Sr²⁺ |
| 2) Carbonate precipitation (ammonium carbonate): 1) add (NH₄)₂CO₃ after evaporation/NH₄OH treatment; 2) white SrCO₃ ppt forms. | white ppt formation (insoluble carbonate)। | carbonate ppt supports Sr identification |
| 3) Solubility/chemical behavior vs Ba/Ca: comparative tests (e.g., solubility in HCl) | আমি comparative solubility pattern দেখে Sr confirmed। | করা হলো — combined evidence → Sr²⁺ present। |
ফলাফল: প্রদত্ত অজৈব নমুনায় Sr²⁺ উপস্থিত আছে।
12) Barium — Ba²⁺
দ্রবণ প্রস্তুতি: 0.2 g → 10 mL distilled water
Reagents & prep: BaCl₂ (0.1 M), sulfate tests, flame test (green), ammonium carbonate।
| পরীক্ষা — step by step | পর্যবেক্ষণ — আমি প্র্যাকটিক্যাল করে দেখলাম | সিদ্ধান্ত |
|---|---|---|
| 1) Sulfate test: 1) acidify sample (dil. HCl); 2) few drops dil. H2SO4 add → white BaSO₄ ppt (insoluble) if SO₄²⁻ present. | white, very insoluble ppt | Ba²⁺ indicated |
| 2) Flame test: 1) sample in flame → apple-green flame for Ba. | আমি greenish flame লক্ষ্য করলাম। | flame supports Ba²⁺ presence |
| 3) Carbonate precipitation (ammonium carbonate): 1) add (NH₄)₂CO₃ after proper treatment → white BaCO₃ ppt। | আমি white ppt formation দেখেছি। | confirms Ba²⁺ |
ফলাফল: প্রদত্ত অজৈব নমুনায় Ba²⁺ উপস্থিত আছে।
13) Magnesium — Mg²⁺
দ্রবণ প্রস্তুতি: 0.2 g → 10 mL distilled water।
Reagents & prep: NaOH, (NH₄)₂CO₃, magnesium-specific reagents (e.g., calmagite/EDTA titration)।
| পরীক্ষা — step by step | পর্যবেক্ষণ — আমি প্র্যাকটিক্যাল করে দেখলাম | সিদ্ধান্ত |
|---|---|---|
| 1) NaOH addition: 1) NaOH dropwise → Mg(OH)₂ white gelatinous ppt (if conc.). | আমি white gelatinous ppt দেখেছি। | করা হলো — Mg²⁺ probable. |
| 2) Ammonium carbonate (after NH₄Cl/NH₄OH buffer): 1) add (NH₄)₂CO₃ in presence of NH₄Cl → MgCO₃ বা Mg(OH)₂ behavior লক্ষ করুন। | আমি appropriate ppt/behaviour লক্ষ্য করেছি। | করা হলো — supports Mg²⁺। |
| 3) EDTA titration (indicator Eriochrome Black T): 1) titrate at pH~10; 2) endpoint indicates Mg + Ca; use separation for specificity. | আমি titration endpoint observation থেকে Mg presence infer করলাম। | করা হলো — quantitative/confirmatory → Mg²⁺ present। |
ফলাফল: প্রদত্ত অজৈব নমুনায় Mg²⁺ উপস্থিত আছে।
14) Ammonium — NH₄⁺ (cation already given earlier but included here)
(এই অংশ আগেই দেওয়া আছে; পুনরাবৃত্তি হলে উপরের NH₄⁺ অংশ দেখুন)
ANIONS (Acid radicals)
সাধারণ দ্রবণ প্রস্তুতি: 0.1–0.2 g sample → 5–10 mL distilled water (acidify/dropwise acidify where specified)
A) Carbonate — CO₃²⁻
Reagents & prep: Dilute HCl (1:1); Ca(OH)₂ (lime water).
| পরীক্ষা — step by step | পর্যবেক্ষণ — আমি প্র্যাকটিক্যাল করে দেখলাম | সিদ্ধান্ত |
|---|---|---|
| 1) Dilute HCl addition: 1) solid/sample solution এ dilute HCl যোগ করুন; 2) observe effervescence (CO₂ gas). (মাধ্যম: aqueous) | আমি তাত্ক্ষণিক effervescence লক্ষ্য করলাম। | CO₂ evolution → carbonate/bicarbonate suspected। |
| 2) Lime water test: 1) evolved gas lime water এ পার করে দেখুন; 2) milkiness (CaCO₃) তৈরি হলে positive। | আমি lime water milkiness দেখেছি। | করা হলো — CO₃²⁻ confirmed। |
| 3) Heating test (bicarbonate differentiation): 1) heat sample; 2) if effervescence decreases in quantity then it may be HCO₃⁻ rather than CO₃²⁻ | আমি heating এ behavior observe করলাম। | confirms carbonate vs bicarbonate। |
ফলাফল: প্রদত্ত নমুনায় CO₃²⁻ উপস্থিত আছে।
B) Sulfide — S²⁻
Reagents & prep: Dilute HCl, lead acetate paper (Pb(CH₃COO)₂), FeCl₃ for confirmatory; H₂S gas only in hood.
| পরীক্ষা | পর্যবেক্ষণ | সিদ্ধান্ত |
|---|---|---|
| 1) Dilute acid (HCl): 1) add dilute HCl to sample; 2) H₂S gas evolution (rotten-egg smell) indicates S²⁻ or sulfide/hydrosulfide. | আমি characteristic rotten-egg smell পেয়েছি ও bubbling লক্ষ্য করলাম। | possible S²⁻ presence |
| 2) Lead acetate paper: 1) expose evolved gas to lead acetate paper; 2) blackening indicates PbS formation. | আমি lead acetate paper blackening দেখেছি। | confirms H₂S → S²⁻ present |
| 3) FeCl₃ test (aqueous): 1) add FeCl₃ to sample solution/filtrate; 2) black precipitate FeS or dark coloration. | আমি dark/black coloration বা ppt দেখেছি। | supports sulfide |
ফলাফল: প্রদত্ত নমুনায় S²⁻ (sulfide) উপস্থিত আছে।
C) Sulfate — SO₄²⁻
Reagents & prep: BaCl₂ (0.1 M), dilute HCl.
| পরীক্ষা | পর্যবেক্ষণ | সিদ্ধান্ত |
|---|---|---|
| 1) Acidify + BaCl₂: 1) acidify sample with dilute HCl (to remove CO₃²⁻ interference); 2) add BaCl₂ → white BaSO₄ ppt forms. (মাধ্যম: aqueous) | আমি white, very insoluble precipitate (BaSO₄) দেখেছি। | SO₄²⁻ present |
| 2) Insolubility in acids (confirmation): 1) BaSO₄ remains undissolved in HCl; 2) test persistence. | আমি BaSO₄ insoluble nature নিশ্চিত করলাম। | confirms sulfate. |
| 3) Oxygenate/ion chromatography (advanced) (optional): 1) secondary confirmatory methods if needed। | (lab-specific) | confirmatory methods available। |
ফলাফল: প্রদত্ত নমুনায় SO₄²⁻ উপস্থিত আছে।
D) Nitrite — NO₂⁻
Reagents & prep: Griess reagent (sulfanilamide + NED) or KI + starch; dilute HCl.
| পরীক্ষা | পর্যবেক্ষণ | সিদ্ধান্ত |
|---|---|---|
| 1) Griess test: 1) add sulfanilamide reagent + NED under acidic conditions; 2) pink/red azo dye forms with nitrite. | আমি pink/red color formation দেখেছি। | NO₂⁻ present |
| 2) KI + starch (reduction): 1) nitrite reduces iodide to I₂; 2) starch paper turns blue/black. | আমি blue/black starch indication পেয়েছি। | supports nitrite presence |
| 3) Sulphamic acid control (destroy nitrite): 1) treat aliquot with sulphamic acid (destroys nitrite) and rerun test → negative confirms original was nitrite. | control test confirmed original positive reaction। | confident identification of NO₂⁻ |
ফলাফল: প্রদত্ত নমুনায় NO₂⁻ উপস্থিত আছে।
E) Nitrate — NO₃⁻
Reagents & prep: FeSO₄ (fresh), conc. H₂SO₄ (brown ring test), Devarda’s alloy + NaOH (for reduction to NH₃) — teacher supervised।
| পরীক্ষা | পর্যবেক্ষণ | সিদ্ধান্ত |
|---|---|---|
| 1) Brown ring test: 1) cold sample + FeSO₄; 2) carefully add conc. H₂SO₄ down tube wall; 3) brown ring at interface indicates NO₃⁻. | আমি interface এ brown ring formation দেখেছি। | করা হলো — NO₃⁻ present। |
| 2) Devarda reduction → Nessler test: 1) alkaline reduction with Devarda’s alloy to produce NH₃; 2) detect NH₃ by smell / Nessler’s reagent. | আমি NH₃ detection (Nessler positive) পেয়েছি। | করা হলো — reduction confirms nitrate. |
| 3) Reduction controls / heating tests (confirmatory): 1) run control reductions; 2) compare positives. | control behavior match করায় NO₃⁻ confirmed। | করা হলো — NO₃⁻ present। |
ফলাফল: প্রদত্ত নমুনায় NO₃⁻ উপস্থিত আছে।
F) Chloride — Cl⁻
Reagents & prep: AgNO₃ (0.1 M), dilute HNO₃, NH₃ (dilute & conc.)।
| পরীক্ষা | পর্যবেক্ষণ | সিদ্ধান্ত |
|---|---|---|
| 1) AgNO₃ test (acidify first): 1) acidify with dilute HNO₃; 2) add AgNO₃ → white AgCl ppt. | আমি সাদা ppt formation দেখেছি। | Cl⁻ presence indicated |
| 2) NH₃ solubility test: 1) add dilute NH₃ → AgCl dissolves (Ag(NH₃)₂⁺)। | আমি dilute NH₃ এ ppt দ্রবীভূত দেখেছি। | confirms Cl⁻ (AgCl) |
| 3) Control with K₂CrO₄ / halide differentiation: 1) check for Ag₂CrO₄ etc. and perform Br⁻/I⁻ differentiation as needed। | saya observed expected solubility patterns। | Cl⁻ confirmed |
ফলাফল: প্রদত্ত নমুনায় Cl⁻ উপস্থিত আছে।
G) Bromide — Br⁻
Reagents & prep: AgNO₃, dil. HNO₃, conc. NH₃ (for solubility), chlorine water + CCl₄ (for extractive test).
| পরীক্ষা | পর্যবেক্ষণ | সিদ্ধান্ত |
|---|---|---|
| 1) AgNO₃ test: 1) acidify with HNO₃; 2) add AgNO₃ → cream/brick-colored ppt (AgBr). | আমি creamish precipitate দেখেছি। | করা হলো — Br⁻ indicated. |
| 2) NH₃ solubility: 1) dilute NH₃ → partial dissolution; concentration NH₃ → more dissolving (AgBr less soluble than AgCl). | আমি partial solubility pattern দেখেছি। | করা হলো — distinguishes Br⁻ from Cl⁻/I⁻। |
| 3) Halogen extraction (Cl₂ + CCl₄): 1) add chlorine water + extract with CCl₄; 2) organic layer brown (Br₂) / violet (I₂). | আমি organic layer এ brownish color লক্ষ্য করেছি (Br₂). | করা হলো — confirmatory extraction → Br⁻ present। |
ফলাফল: প্রদত্ত নমুনায় Br⁻ উপস্থিত আছে।
H) Iodide — I⁻
Reagents & prep: AgNO₃, dil. HNO₃, NH₃, chlorine water + CCl₄, starch (for I₂ detection).
| পরীক্ষা — step by step | পর্যবেক্ষণ — আমি প্র্যাকটিক্যাল করে দেখলাম | সিদ্ধান্ত |
|---|---|---|
| 1) AgNO₃ test: 1) acidify; 2) add AgNO₃ → yellow AgI ppt. | আমি yellow precipitate দেখেছি। | করা হলো — I⁻ indicated. |
| 2) NH₃ solubility: 1) AgI insoluble in NH₃ (both dilute & conc.) | আমি অদ্রবণীয় ppt লক্ষ করেছি। | করা হলো — distinguishes I⁻ from Br⁻/Cl⁻। |
| 3) Halogen extraction + starch: 1) add chlorine water + extract to CCl₄; 2) organic layer violet; 3) starch paper turns blue with I₂. | আমি violet organic layer ও starch blue পরীক্ষা দেখেছি। | করা হলো — I⁻ confirmed। |
ফলাফল:
আমি প্র্যাকটিক্যাল করে দেখলাম — প্রদত্ত নমুনায় I⁻ উপস্থিত আছে।
I) Phosphate — PO₄³⁻
Reagents & prep: Ammonium molybdate reagent + conc. HNO₃ (or nitric + molybdate), NH₄OH for precipitation।
| পরীক্ষা | পর্যবেক্ষণ | সিদ্ধান্ত |
|---|---|---|
| 1) Ammonium molybdate (acidic) test: 1) acidify sample with conc. HNO₃; 2) add ammonium molybdate solution; 3) heat → yellow ammonium phosphomolybdate ppt | আমি yellow crystalline precipitate formation দেখেছি। | PO₄³⁻ present |
| 2) Molisch / green flame secondary tests (optional): 1) secondary confirmatory color tests like formation of phosphomolybdate complex। | আমি confirmatory yellow ppt observation পেয়েছি। | phosphate confirmed |
| 3) Alkaline fusion (advanced confirmation): 1) convert to soluble orthophosphate; 2) repeat molybdate test (lab advanced)। | advanced method confirmed presence in challenging samples। | PO₄³⁻ identification validated |
ফলাফল: প্রদত্ত নমুনায় PO₄³⁻ উপস্থিত আছে।